阻转手性作为一类重要的手性构成了轴手性化合物的结构特征。以往的合成研究中,轴手性的研究主要集中于轴手性联芳基化合物的不对称催化合成。所采用的策略主要包括有机分子催化和金属催化。而轴手性烯烃即含有C(烯基)-E轴的烯烃的不对称合成相对较为挑战,且大多局限于环状烯烃的轴手性体系。因此,开链轴手性的烯烃(尤其是开链四取代烯烃)的不对称合成更为挑战,这是由于该类烯烃在合成过程中需要克服较大的位阻效应,需要兼顾催化体系的活性和烯烃产物相对较低的阻转能垒。
针对这一科学问题,李兴伟教授研究团队采用不对称碳氢键活化策略。在手性CpXRh(III)催化剂作用下,两类含有可迁移导向基的芳烃在温和、非氧化还原条件下可与大位阻的炔烃发生偶联,通过碳氢键活化与定位基迁移相结合的策略实现了大位阻炔烃的1,2-双官能化。在两类的芳烃中,当采用N-氨酰基吲哚杂环芳烃时,利用该芳烃中表观亲电型定位基的特性,实现了炔烃的1,2-芳酰基化从而实现了手性C-N轴的有效构建(28例产物,80-99% ee)。值得注意的是,该反应体系需要消旋锌盐的辅助以达到优异的对映选择性。当采用N-酚氧基酰胺作为芳烃底物时,基于该底物中氧化性定位基的特性(即N-O键易发生断裂),实现了大位阻炔烃的1,2-芳胺化从而构建了手性C-C轴(31例产物,80-98% ee)。上述催化体系中采用的铑催化剂为同一个,两类反应均具有单一的区域选择性和100%原子经济性。
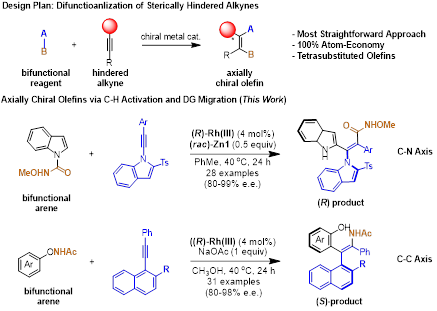
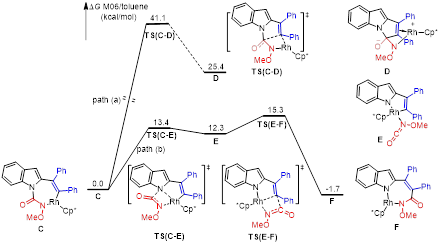
作者通过实验及与郑州大学蓝宇教授团队的理论计算合作,对N-氨酰基吲哚与炔烃的反应机理进行了较为详尽的研究。结果表明,不论二苯乙炔或者吲哚类型的大位阻炔烃作为偶联试剂时反应的机理都是一致的。该反应先经历脲导向的碳氢活化后,发生炔烃区域选择性迁移插入,得到七元铑环中间体C。该中间体并没有发生铑碳键对临近的羰基的亲核进攻或迁移插入(脲羰基的活性低),而是发生β-N消除,得到五元环状铑的异氰酸酯中间体E。该中间体进一步发生异氰酸酯对铑碳键的插入和之后两次质子解最终得到轴手性烯烃产物。除了机理研究外,作者也将得到的轴手性烯烃作为手性添加剂,应用于铑催化不对称碳氢键活化-环化反应(芳烃去对称化)中。
总之,李兴伟团队在前期不对称碳氢键活化基础上(该团队近期其它轴手性体系见:J. Am. Chem. Soc. 2019, 141, 9527-9532, Angew. Chem. Int. Ed. 2020, 59, 7188-7192, Angew. Chem. Int. Ed. 2020, 59, 13288-13294, Angew. Chem. Int. Ed. 2021, 60, 8391-8395, Angew. Chem. Int. Ed. 2021, 60, 16628-16633, Angew. Chem. Int. Ed. 2021, 60, 20424-20429, ACS Catal. 2021, 11, 9151-9158),实现了较为少见的轴手性四取代烯烃的有效构建。反应具有条件温和、底物范围广、立体选择性优异、原子效率高等优点。该工作为轴手性烯烃的构建提供了新的思路。该工作以VIP论文形式发表在Angew. Chem. (https://onlinelibrary.wiley.com/doi/10.1002/anie.202111860),得到了国家自然基金委和williamhill威廉希尔官网的经费支持。

